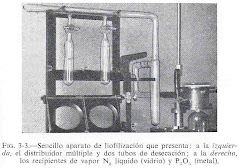
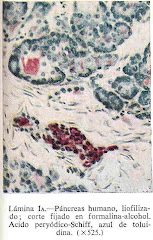
"La fijación es esencialmente un método para la preservación de la morfología y composición química de la célula. Durante la fijación, las sustancias albuminoides del tejido pasan del estado sol, como se encuentran en vida, al de gel, cuyo contenido de agua es menor. De esta manera, se detienen los procesos posmortem y las estructuras se conservan con un mínimo de artificios, preparándolas para tratamientos ulteriores (Thompson 1966, García del Moral 1993, Eltoum et al. 2001)".
Las muestras obtenidas, sean biopsias, necropsias, exudados, derrames o punciones, deben sumergirse rápidamente en el reactivo fijador previamente seleccionado, a fin de que los tejidos no sufran alteraciones estructurales producidas por los siguientes fenómenos:
1. Acción de enzimas locales que provoca procesos autolíticos en el tejido.
2. Proliferación de bacterias y hongos provenientes del medio ambiente o de la misma muestra, los cuales desarrollan en condiciones anaeróbicas.
3. Evaporación por desecación de los componentes tisulares con eliminación de gases por descomposición orgánica.
4. Contracción o dilatación osmótica, que produce distorsión tisular como consecuencia de la evaporación.
El reactivo fijador se debe seleccionar antes de comenzar con la toma de la muestra. La selección depende del objeto de estudio y del grado de organización macromolecular que compone cada tejido. En los componentes tisulares organizados, tales como cromosomas, fibras elásticas, regiones organizadoras del nucléolo, depósitos de glucógeno, entre otros, existe un gran número de fuerzas intermoleculares que actúan entre sí manteniéndolos unidos y estables y, por tanto, son menos vulnerables a la acción del reactivo fijador. Es decir que, si bien la actividad fijadora del reactivo es suficiente para detener los procesos posmortem, éste no produce alteraciones estereoquímicas importantes en aquellos componentes.
En cambio, en regiones tisulares menos organizadas, como es el caso de la matriz extra e intracelular, la preservación se vuelve más dificultosa, con producción de artificios de fijación, que incluye disolución de lipocompuestos, aglutinación de estructuras fibrilares próximas, halo perinuclear, difusión de inclusiones citoplasmáticas, dehiscencias, etc. Así por ejemplo, para realizar estudios de bandas cromosómicas se recomienda un fijador reductor de acción deshidratante (metanol); para estudios nucleares se emplean mezclas formólicas o alcohólicas ácidas, ya que se debe preservar no sólo la cromatina, sino también la matriz y membrana nuclear (Líquido de Clarke). Para el estudio de tejidos vegetales se utilizan líquidos deshidratantes con escasa fuerza iónica, Líquido FAA (Jensen 1962); en estudios inmunohistoquímicos es aconsejable emplear reactivos fijadores reticulizantes (glioxal o formol).
 Corte histológico de yeyuno. La flecha indica la dehiscencia producida entre el tejido
Corte histológico de yeyuno. La flecha indica la dehiscencia producida entre el tejidomuscular y el conectivo. Tinción con hematoxilina, 400X.
Con el propósito de lograr una correcta fijación es conveniente tener en cuenta los siguientes puntos:
a. La muestra en estudio se debe seccionar, durante la macroscopía, en pequeños fragmentos de 5 mm de diámetro mayor para que el reactivo fijador alcance rápidamente las capas tisulares más profundas de la muestra. El seccionamiento se debe realizar con bisturí nuevo, a fin de evitar compresión mecánica que deforme la muestra en estudio. 
el primer paso de todo estudio histológico.
Una muestra de células, tejido u órgano se puede obtener de un animal o vegetal vivo (biopsia) o muerto (necropsia). Las muestras biológicas que se reciben en el laboratorio deben venir fijadas desde el lugar de la toma para que las mismas estén adecuadamente preservadas. Tras ingresar los datos de la muestra en el Libro de Entrada del Laboratorio, el profesional especializado debe realizar un estudio macroscópico del espécimen, procediendo de la siguiente manera:
- Observación
- Pesaje y medición
- Palpación
- Fragmentación de la muestra
- Trascripción de todo lo anterior.
Durante la fragmentación de la muestra se deben obtener secciones pequeñas, de manera tal que uno de sus lados sea menor a 5 mm de espesor para asegurar la correcta infiltración de las sustancias químicas que se utilizarán posteriormente. Si se trata de células se deben extender sobre un portaobjetos formando una capa delgada que permita su visualización sin superposiciones celulares (frotis celular).
b. El volumen del agente fijador debe ser mayor que el volumen que ocupa la muestra (10:1). En caso de emplear reactivos que pierden su eficacia con rapidez, tal como sucede con la acetona (se evapora fácilmente), se debe renovar respetando siempre la misma relación volumétrica.
c. Los fragmentos seccionados y listos para ser procesados se deben transportar en bolsitas de gasa pendientes de un hilo, en cuyo extremo libre se coloca un rótulo con los datos identificatorios de la muestra escritos con lápiz. Desde hace algunos años, no obstante, se utilizan grillas plásticas “cassettes”, que facilitan la tarea de procesamiento y archivo. En ambos casos el reactivo fijador actúa homogéneamente por todas las caras de la muestra.
Si las muestras se sumergen en el líquido fijador sin el uso de estos contenedores es conveniente cubrir con gasa el fondo del recipiente para que la muestra no toque dicho fondo y se fije incorrectamente de ese lado. Las muestras que presentan grasa (biopsias de mama) o aire (biopsias de pulmón) tienden a flotar en el fijador y para evitarlo, se debe cubrir con gasa a fin de mantenerlas sumergidas en el reactivo.
d. La presión osmótica es un factor importante que generalmente no se tiene en cuenta. La capacidad de un fijador para provocar fenómenos de retracción o dilatación tisular depende principalmente de los cambios inducidos sobre la presión osmótica en los tejidos. La osmolaridad del plasma humano es alrededor de 290 mOs/Kg, por tanto, es razonable asumir que las células humanas actúan dentro de ese valor, mientras que entre especies hay pequeñas diferencias: 310 mOs/Kg en ratas, 270 mOs/Kg en tejidos vegetales.
De esta manera, en la práctica, se acepta trabajar entre 270 y 320 mOs/Kg. Si se trabaja bajo riesgo de evaporación del disolvente en el cual se disuelve el fijador es recomendable preparar soluciones fijadoras ligeramente hipotónicas para evitar que las sales que componen el sistema buffer del fijador se concentren.
De no considerarse tal recomendación podría suceder que cuando se somete un tejido a la acción de un reactivo fijador y la presión osmótica entre ambos no es coincidente, se produzca un flujo de agua entre el fijador y el tejido en función de un fenómeno de ósmosis hasta que la presión entre ellos se equilibre. Si la presión osmótica del tejido es superior a la del fijador, el agua difunde hacia el interior del tejido, produciéndose dilatación y posterior destrucción celular. En cambio, el agua del tejido fluye hacia el exterior del espécimen y ocurre una retracción tisular, si la concentración de las sales del fijador es superior. De esta manera, la concentración de iones fosfatos, cloruros, sodio o potasio del buffer-disolvente del fijador debe ser isotónica respecto a la osmolaridad del tejido.
La osmolaridad de una solución fijadora se mide a través de la elevación de su presión de vapor en un Osmómetro. Sin embargo, esta medición puede evitarse, tras preparar la solución fijador-buffer empleando las proporciones indicadas en el punto siguiente. Por otra parte, antes de fijar la muestra es conveniente lavarla con solución fisiológica (ClNa 0,9% que equivale a 280 mOs/Kg y cuya molaridad es de 0,15M) para evitar la producción de artificios de técnica debido a la susceptibilidad que tienen los tejidos de dilatarse o contraerse cuando se los sumergen en líquidos hipo o hipertónicos.
e. El potencial de hidrogeniones (pH) debe ser el adecuado. Así por ejemplo, se sabe que a pH inferior a 5.0, las proteínas del tejido se fijan lentamente con formol, mientras que a pH superiores a 7.2, la unión entre este agente fijador y dichas proteínas es más rápido y, por tanto, los procesos autolíticos desencadenados por enzimas se detendrán con mayor efectividad (Baker 1958). En la literatura, sin embargo, hay desacuerdos para establecer relaciones directas entre la concentración de hidrogeniones y el tipo de tejido en estudio. Esto se atribuye, parcialmente, a las impurezas químicas que presentan los reactivos utilizados en los laboratorios biológicos, ya que depende de la marca comercial empleada. El pH se controla con soluciones buffer, el cual oscila, generalmente, entre 6.9 y 7.4, más precisamente 7.2. Así por ejemplo, para preparar formol buffer al 4% se debe mezclar:
Fosfato monopotásico ..... 0.20 gr
Cloruro de potasio ........... 0.20 gr
Fosfato disódico .............. 0.93 gr
Cloruro de sodio .............. 8.00 gr
Formaldehído .................. 100 ml
Agua destilada c.s.p. ....... 900 ml
Los efectos indeseados que pueden producirse por el uso de soluciones fijadoras no tamponadas se manifiestan, fundamentalmente, en cambios conformacionales de proteínas y otros componentes tisulares, con resultados infructuosos en técnicas tales como hibridización in situ, PCR o enzimo e inmunohistoquímica.
f. Cada reactivo fijador tiene un tiempo óptimo de fijación y depende de:
1. Concentración del fijador. Mencionamos con anterioridad que la fijación preserva los componentes del tejido al evitar la autólisis y nos asegura, además, que la disposición espacial de las estructuras histológicas permanezca fija cuando éstas se enfrenten a otras fuerzas químicas, ejercidas durante tratamientos ulteriores (por ejemplo durante la deshidratación de la muestra o su inclusión en parafina). Sin embargo, si la concentración del fijador no es la adecuada, éste podría actuar sobre el tejido produciendo deformaciones importantes.
2. Poder de penetración. La velocidad con que el reactivo fijador alcanza las capas más profundas del espécimen, responde a las Leyes de Difusión y depende tanto de la fluidez del líquido fijador como de la reactividad química que se produce entre éste y el tejido (en este caso se habla de fijadores aditivos, tales como el formol, cloruro de mercurio, ácido pícrico, entre otros). A fin de conocer el poder de penetración de estos reactivos se ha establecido un valor K de difusión para cada sustancia fijadora y se debe aplicar según el tamaño de la muestra. Si "d" es la distancia infiltrada, "t" el tiempo de fijación y K la constante de difusión, de valores conocidos, resulta que:
Esta ecuación nos permite determinar el tiempo de fijación si consideramos que "d" se mide en milímetros y K representa la distancia infiltrada en una hora. Como lo que varía es el tamaño de la muestra, el cual se puede medir con una regla milimétrica, sólo nos queda por determinar el tiempo de exposición en horas para que la muestra se fije correctamente:
3. Temperatura de fijación. En la mayoría de los métodos descriptos, la temperatura que se utiliza para fijar una muestra biológica se encuentra entre los 15 y 25°C. No es recomendable trabajar con temperaturas superiores a la indicada, ya que se producen alteraciones importantes en el tejido. Se hace excepción a una técnica, que en Anatomía Patológica se denomina "Biopsia por Congelación", donde la solución de formol tiene una temperatura de 60°C para acelerar el proceso de fijación. En estudios enzimo e inmunohistoquímicos, hibridización in situ y PCR se recomienda fijar a temperaturas bajas (4º C).
4. Tamaño de la muestra. Mientras más pequeños son los fragmentos a procesar, menor será el tiempo de exposición.
Para comentarios y foros de debate ir a página principal.
Clasificación de los agentes fijadores
Los reactivos fijadores se clasifican de acuerdo a la acción que ejercen sobre el tejido, los cuales se dividen en dos grandes grupos en función a los eventos físicos y/o químicos que producen.
Fijadores Físicos: En técnica histológica propiamente dicha, los métodos físicos de fijación no tienen aplicación general, a excepción de las técnicas de Congelación-Desecación al vacío e Irradiación con Microondas.
La Desecación detiene los procesos posmortem y, si se realiza rápidamente tras obtener la muestra, se evita la aparición de artificios. Esta técnica se utiliza en extendidos de sangre y frotis de líquidos orgánicos en general que contienen elementos celulares en suspensión, tales como lavados bronquiales, derrames peritoneales, secreciones mamarias anormales o esputo. Los frotis pueden conservarse por poco tiempo, por tanto, antes de colorearlos, es necesario proceder a la fijación química a fin de provocar la precipitación de las proteínas, empleando para ello un fijador químico (metanol).
Calor seco se realiza flameando el frotis celular sobre la llama de un mechero; este método es muy empleado en bacteriología. El Calor húmedo se utiliza en forma de agua hirviente para estudiar pequeños invertebrados, organismos unicelulares y en ensayos microcitoquímicos.
El Ultrasonido se utiliza para la fijación de especímenes o fragmentos de estos muy pequeños. Este método se realiza sumergiendo la muestra, preferentemente, en solución de Tyrode:
Posteriormente, se coloca el dispositivo ultrasonicador próximo a la muestra, ajustando el sistema para que trabaje entre 10.000 y 15.000 ciclos por segundo a 30ºC.
El Frío no es un verdadero agente fijador. Bajo su acción se detienen los procesos vitales de autólisis y cadavéricos de necrosis; sin embargo, en el momento en que deja de actuar se reinician las actividades enzimáticas normales de los tejidos, provocando distorsiones tisulares autolíticas. Por tanto, el frío intenso, por debajo de –20ºC, permite “preservar” la muestra durante tiempos prolongados, ya que la cristalización de las moléculas de agua a esa temperatura no provoca alteraciones en la arquitectura del tejido (por ejemplo, el nitrógeno líquido mantiene la temperatura a –180ºC). Este método de preservación tiene aplicación en técnicas de inmunofluorescencia directa y en patología muscular.
El método de Congelación-Desecación consiste en congelar a –160ºC, la muestra de tejido inmediatamente después de su extracción y luego en deshidratarla al vacío, también a temperatura baja (-80ºC). El vacío se debe ajustar de tal manera que la tensión de vapor de agua del tejido sea superior a la tensión de vapor de agua de la cámara donde se realiza la deshidratación. Producida esa diferencia de tensiones, el agua contenida en el tejido en estado sólido sublima y la muestra se deshidrata, provocando la precipitación de las proteínas solubles y estructurales.
La irradiación con Microondas acelera los tiempos de procesamiento de las muestras con gran eficacia, inclusive la fijación. Por ello, la aplicación del microondas en técnica histológica ha ganado aceptación en los laboratorios de anatomía patológica, debido a la calidad de los resultados obtenidos. Dicha aplicación se debe fundamentalmente, a que los fabricantes de Microondas han desarrollado aparatos de gran precisión y que el personal técnico ha logrado mayor destreza en el manejo y ajuste metodológico del Microondas para el correcto procesamiento de las muestras.
Estos aparatos sofisticados son aún costosos y los laboratorios que los emplean son pocos. Sin embargo, se ha hecho común que en muchos laboratorios comenzaran a realizar, con excelentes protocolos de experimentación, pruebas de fijación, procesamiento de inclusión en parafina, coloraciones de rutina e inmunomarcaciones, utilizando los tradicionales hornos de microondas domésticos con resultados satisfactorios.
La irradiación con microondas puede acelerar el tiempo insumido durante el procesado del material histológico. De acuerdo a Gu y colaboradores (1990), el horno de microondas trabaja, al menos, por dos mecanismos:
1. Por el fuerte incremento del movimiento molecular y
2. Por el aumento de la temperatura, que se produce simultáneamente con el calor, pero de manera uniforme y rápida.
De esta manera, hay un efecto significativo de las microondas, además del calentamiento del sistema, sobre la velocidad de las reacciones químicas que se establecen entre los reactivos que se utilizan para el procesamiento de la muestra (por ejemplo, formol) y los componentes moleculares que constituyen células y tejidos (por ejemplo, proteínas estructurales de membranas). Tanto el efecto de calentamiento como la cinética molecular se encuentran solapados y es difícil distinguir uno del otro. Sin embargo, no hay dudas que en todas las reacciones químicas producidas durante el procesamiento del tejido y coloración posterior se pueden acelerar por el mayor movimiento molecular con incremento de la temperatura y ésta es la única ventaja fundamental que aporta el horno de microondas.
En otras palabras, las microondas actúan como co-factor físico sobre las moléculas químicas, éstas vibran con mayor velocidad, favoreciendo reacciones rápidas y uniformes entre los reactantes (formol - proteínas), con aumento de la temperatura que, a su vez, también acelera las reacciones en el sistema. La clave para trabajar con el horno es encontrar la temperatura (como signo de la calidad y cantidad de microondas irradiadas) y la duración ideal de la irradiación para cada reacción o protocolo de trabajo.
Hay muchos aparatos de microondas en el mercado, los fabricados para técnica histológica y los de uso doméstico. Estos últimos pueden tener sensor, bandeja giratoria, reloj de precisión, controlador de potencia de irradiación o termómetro. Los hornos más sofisticados presentan estos y otros aditamentos; en cambio, los microondas domésticos presentan características particulares y limitaciones, ya que no reúnen todos los requerimientos. Sin embargo, tal como lo señalamos con anterioridad, se puede ajustar un método de procesamiento histológico a través de un adecuado diseño experimental. Por ello, describiremos algunos puntos para tener en cuenta en el momento de emplear irradiación con microondas:
Las Microondas y el dispositivo: El horno de microondas emplea un sensor que, a través del calentamiento alcanzado por el sistema, controla automáticamente el “encendido/apagado” de la irradiación. Esto es, que la temperatura de las soluciones de fijación, deshidratación, parafina, reactivos de coloración o inmunosueros, permanecen constantemente controlados por el sensor (si la fijación de una biopsia renal con formol-buffer se debe hacer a 37ºC durante 5 minutos, el sensor controlará que el sistema químico “formol/tejido” no supere esa temperatura durante todo ese tiempo). La placa de irradiación, conocida como Magnetrón, es el dispositivo que produce las microondas en el horno. Esta placa debería tener, convenientemente, un tiempo de ciclo corto. Todos los hornos de microondas sin sensor modulan su energía por variación de la duración de la irradiación (ciclo de tiempo). Por ejemplo, el magnetrón de un microondas doméstico programado con un ciclo de tiempo de 20 minutos y un nivel de potencia al 50%, permanece encendido 10 minutos y los otros 10 minutos apagado. De este ejemplo, debe entenderse que la placa se activará automáticamente para irradiar con una distribución temporal equilibrada durante los 20 minutos; la suma de los momentos en que el magnetrón irradia será de 10 minutos y, obviamente, también lo será la sumatoria de los momentos cuando la placa está apagada. Determinar tiempos y potencias de exposición con hornos sin sensor es más difícil, ya que no sabemos a qué temperatura trabaja el sistema, a menos que la controlemos con un termómetro manual (con el microondas apagado!).
Si el horno tiene sensor podemos controlar el tiempo de irradiación con más facilidad, ya que la temperatura es quien indica los momentos de activación del dispositivo de microondas. Por ejemplo, un horno programado con un ciclo de tiempo de 20 minutos a un nivel de potencia del 80%, la placa se activará el 80% del tiempo mientras transcurren los 20 minutos. En este caso, la temperatura será mayor si la comparamos con el ejemplo anterior; mientras que si el horno tiene sensor y lo programamos a una temperatura de 40ºC, la placa se encenderá el 80% del tiempo total correspondiente a los 20 minutos, pero sin superar la temperatura indicada.
Volumen y evaporación: Mientras mayor sea la potencia de irradiación, temperatura o tiempo de exposición, mayor será la evaporación o volatilización de los reactivos (Turner et al. 1990). El cambio de volumen producido como consecuencia de la evaporación compromete la osmolaridad y el potencial de hidrogeniones del formol-buffer, los cuales pueden producir artificios de fijación. Al respecto, recomendamos utilizar recipientes de plástico o vidrio termoresistentes que contengan gran cantidad de solución.
Por otra parte, la distribución de las microondas en la cámara del horno durante los 20 minutos no es homogénea y, por tanto, es conveniente trabajar con un aparato que tenga bandeja giratoria. En el esquema se muestra el rebote que presentan las microondas sobre las paredes del aparato (Hasegawa et al. 2000):

Si el microondas no tiene dicha bandeja, el recipiente que contiene la biopsia se puede girar manualmente en cuatro oportunidades de 5 minutos cada una, a fin de que las muestras reciban energía por todas sus caras.
Temperatura y duración: En general, no hay una temperatura óptima, ya que depende no solo del horno, sino también de la concentración del formol, sus impurezas y del tamaño de la muestra. Por ello, no recomendamos procesar juntas las muestras que presentan diferentes tamaños (biopsia renal con una pieza quirúrgica de mama). Se deberían utilizar varios recipientes separando las muestras según su tamaño, comenzar el trabajo al mismo tiempo e ir retirando las de menor tamaño a medida que se fijen correctamente.
El rango ideal de temperatura es entre 25º y 40ºC para la fijación, deshidratación y xilolación y hasta 60ºC con parafina, las que se deben ajustar con la duración de la irradiación. Entre temperatura y duración existe una relación inversa: mientras mayor sea la temperatura, menor será la duración de la irradiación y viceversa. Por ello, el punto óptimo de ajuste del microondas para cada muestra debería ser: 1. El suficiente, en términos de duración, como para que los reactantes interactúen y la muestra se fije adecuadamente. 2. Evitando el exceso de temperatura que pueda provocar distorsiones en la arquitectura del tejido.
Para conocer los conceptos fundamentales sobre Fijadores Químicos.
Para comentarios y foros de debate ir a página principal.
VHT